이전 글에 BSA의 disfulide-bond 결합분석법과 Herceptin의 disufide-bound peptide를 ETD-PRM-CID MS3로 분석하는 법을 적었습니다.
BSA를 이용한 Disulfide-linked Peptides 검출법
ETD-PRM-CID MS3를 이용한 Herceptin Disulfide-bond Peptide 분석
이전의 실험과 유사하지만 이번에는 Intra- disulfide-bond 결합으로 이루어진 펩타이드를 ETD-PRM-CID MS3로 분석해보았습니다. Intra는 한 펩타이드에 여러개의 cysteine이 있을 경우 한 펩타이드에서 disfulfide-bond가 이루어진 형태입니다. 이전에 분석했던 BSA의 intra- disulfide-bond 펩타이드 (LVNELTEFAKTCVADESHAGCEK)를 이용하여 테스트를 하였습니다.
아래는 MS1에서 얻어진 해당 펩타이드의 Precursor ion입니다. Disulfide-bond가 결합되지 않을 경우 이론적인 m/z 값은 832.0578 (3+)이 됩니다. 하지만 S-S 결합으로 인해 2개의 H가 떨어진 상태임으로 2 Da이 적은 값이 m/z 831.3856 (3+)이 검출되었습니다.
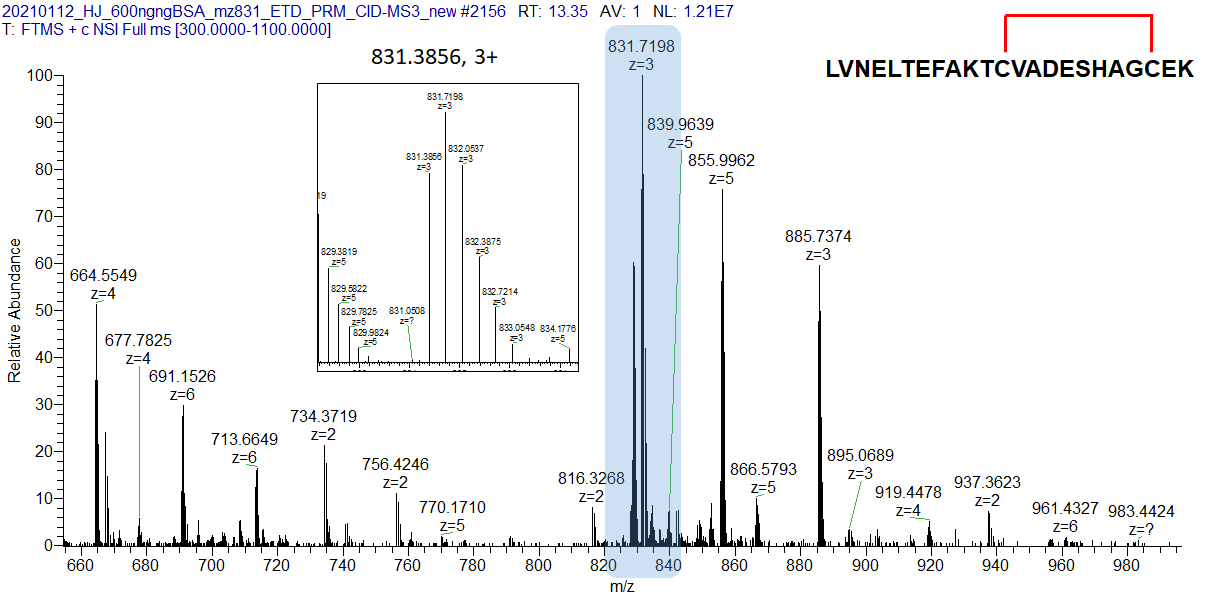
ETD fragmentation에서 아래와 같은 스펙트럼이 나오게 됩니다. Precursor ion과 동일한 피크가 나왔습니다. 아마 ETD 조건이 잘 맞지 않던지 아니면 S-S 결합으로 인해 ETD에서 fragmentation이 잘 안되었는지 차후 확인 필요합니다.

아무튼 2+에 해당하는 피크를 PRM-CID MS3 (iontrap)로 분석하였습니다. 아래는 해당 크로마토그램입니다. y 이온들이 많이 검출이 되었습니다.
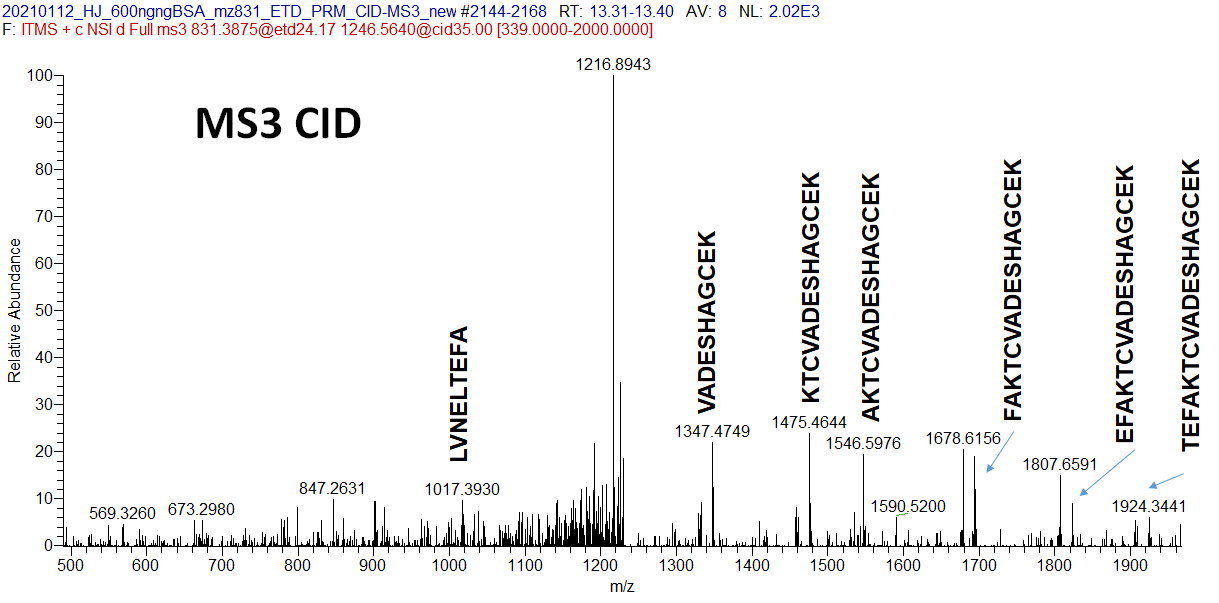
아래는 LVNELTEFAKTCVADESHAGCEK (m/z 831.38750, 3+) 에 해당하는 MS2 HCD(Orbitrap) 와 CID(Orbitrap) 스펙트럼입니다. 스펙트럼에서도 보듯이 Intra S-S 결합 펩타이드의 경우 MS2로 직접 검출한것이 더 좋아보입니다.

MS2 HCD로 분석한 raw 파일을 Proteome discovere로 검색을 했습니다. S-S 결합으로 인해 2개의 H+가 떨어진 형태이기 때문에 아래와 같이 dehydro(-1.008 Da) 옵션을 추가하였습니다.

아래 스펙트럼에서 보듯이 10 ppm 이내에서 많은 이온이 matching 되었습니다.
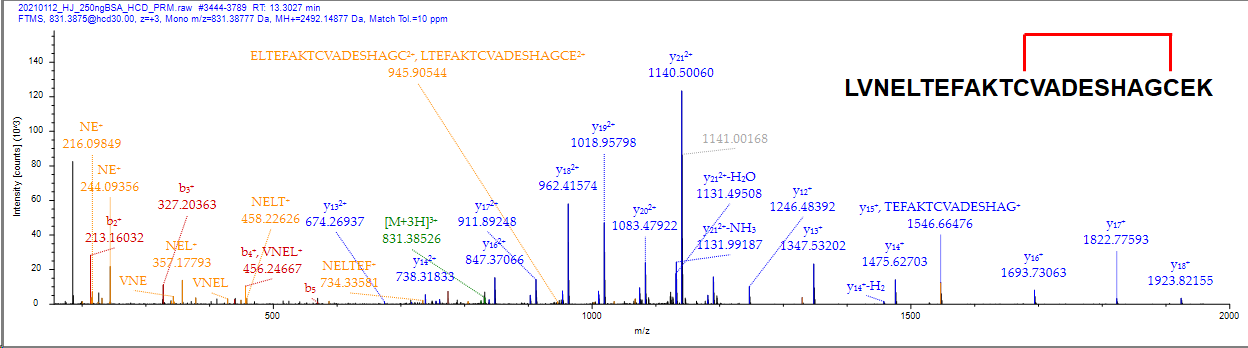
결론적으로는 Intra- S-S 결합 펩타이드의 경우 굳이 ETD를 걸쳐 MS3로 분석하는것에서 혜택이 없는것같습니다.
'프로테오믹스(단백체학)' 카테고리의 다른 글
| Thermo Easy nLC method 설정 방법 (0) | 2021.01.27 |
|---|---|
| In-source fragmentation (CID) for N-linked peptide Characterization (0) | 2021.01.23 |
| In-source fragmentation (CID) for peptide fragmentation (0) | 2021.01.20 |
| AttractSPE Disk Bio C18 를 이용한 펩타이드 정제 (Peptide clean-up) (0) | 2021.01.18 |
| ETD-PRM-CID MS3를 이용한 Herceptin Disulfide-bond Peptide 분석 (0) | 2021.01.15 |




댓글