최근에 많은 사람들이 사용하고 있는 ProtiFi 사의 S-Trap 를 간단히 테스트해 보았다.
1) In-solution digestion과 비교를 통한 tryptic digestion efficiency와 sample loss 비교
2) 소량의 단일 단백질 (2 µg BSA)에 대한 tryptic digestion efficiency와 sample loss 검증
개인적으로 업체에서 제공하는 결과는 100%까지는 신뢰하지 않는다. 보통 좋은 결과가 나올수 있는 최적화된 조건에서 얻은 결과임으로 일반 실험실에서는 동일한 결과가 나오지 않는다.
또한 시료전처리 Kit의 경우 일반적으로 실험실에서 사용하는 방법에 비해 가격이 비싸고 적용할수있는 시료의 양에 제한이 많을때가 있다. 하지만 장점이라면 시약등을 따로 만들지 않아도 되어 시간적으로 혜택이 있다.
시중에 protein extraction이나 enzymatic digestion과 관련된 kit들이 많이 나오지만 고전적인 방법과 비교해서 큰 돈을 지불할만큼의 높은 효율성은 아닐때가 많다. 사실 S-trap로 그러한 kit중 하나라고 생각했으나 개인적은 테스트를 해보니 장점들이 많았다.
가장 큰 장점은 SDS등 질량분석기에서는 사용할수 없는 Buffer를 아주 효율적으로 제거하는것이다. SDS buffer는 cell 이나 tissue에서 단백질을 추출하는데 아주 효율적인나 그들의 물리화학적특성때문에 질량분석전까지 제거의 아주 어렵다는 단점을 가지고 있다. Filter-Aided Sample Preparation (FASP) 가 이러한 목적으로 사용하고 있으나 개인적으로는 시료손실이 상당히 많은 것같고 또한 여러 연구자들 사이에 아직까지 효율성에 대한 의문점이 많은것같다.
아무튼 S-trap kit에 대한 확신을 갖기 위해서 몇가지 테스트를 했다.
1) An efficiency of Clean-up and yield
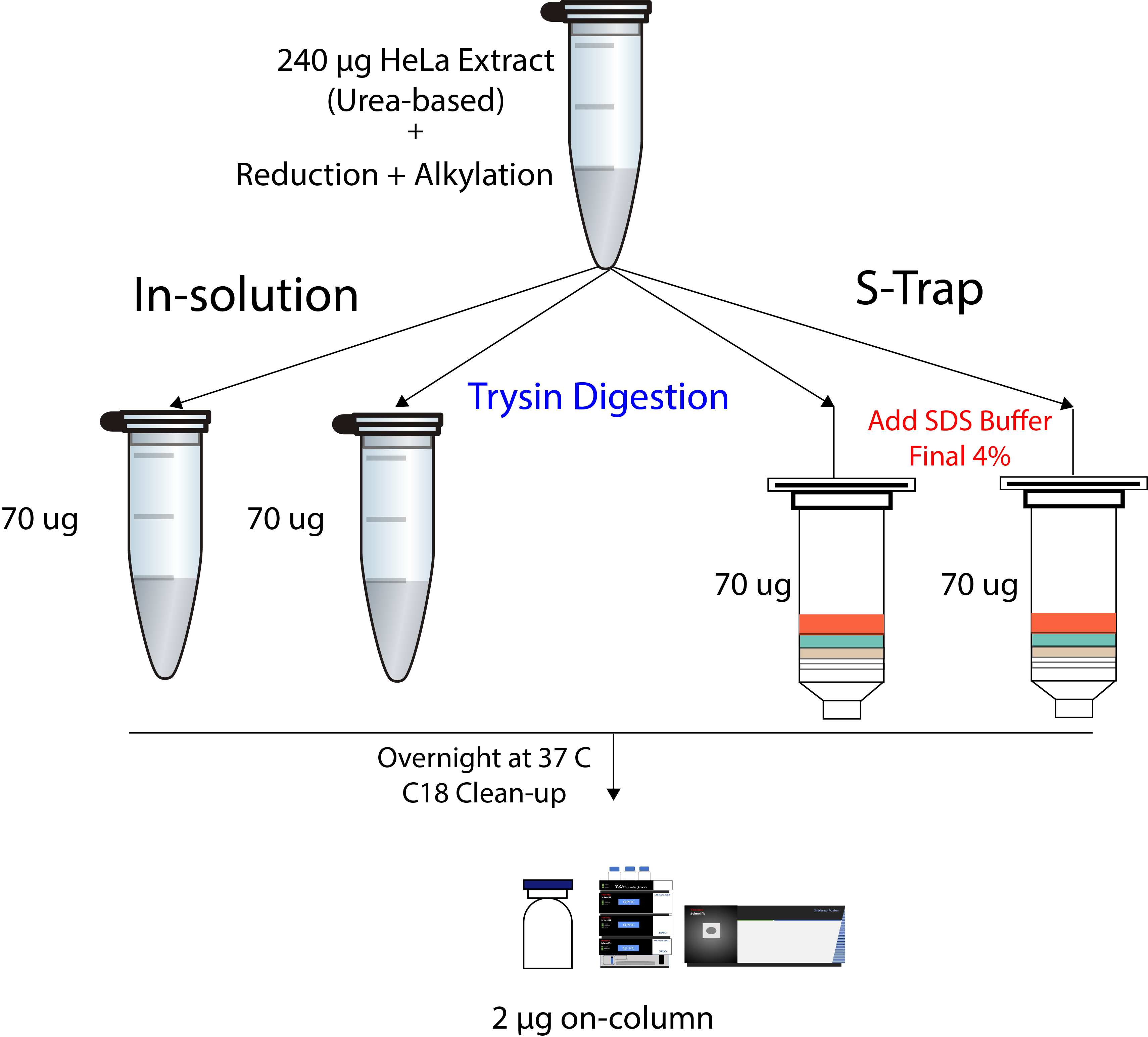
S-trap 에 loading 한 이후부터의 효율성을 테스트하기 위해서 아래와 같이 진행하였다. 먼저 Urea-based 추출한 HeLa extract를 reduction과 alkylation 기존방법 (in-solution) 과 S-trap 방법으로 trypsin digestion을 진행하였다. Kit의 loading capacity가 최대 100 µg임으로 70 µg에서 진행하였다.
일단 In-solution digestion은 tube에서 진행하는것임으로 손실이 없다는것을 가정하였고 S-trap의 경우 filtering 과정에서의 시료 손실을 In-solution과 비교하면 된다. 37도에서 Overnight으로 진행한후 C18 컬럼으로 clean-up 하였다.
분석은 2 µg씩 주입하였다.
아래 그림은 각각의 분석에서 얻어진 크로마토그램이다. 그림에서 보듯이 크로마토그램 상에서는 거의 큰 차이는 없었다 (Figure 2). 이는 S-trap과정이 In-solution 과 비교했을때 시료손실이 거의 없다는 것을 말해준다.

하지만 S-trap을 사용하지 않은 크로마토그램(위)에서 보이는 (약 46분)는 불순물 피크가 S-trap 처리시(아래)에서는 거의 보이지 않았다 (Figure 3). S-trap과정에서 이러한 Hydrophic substances들이 제거되것이라 생각된다.

Proteome Discoverer 를 통해 검출된 각각 단백질과 펩타이드 수이다 (Figure 4). 그래프에서 보듯이 S-trap에서 검출된 수에서도 기존의 방법에서 얻어진 수와 거의 동일하다. SDS-buffer과 포함된 S-trap digestion과정에서 단백질의 손실이 없었음을 알 수 있다. 즉 단백질 추출에서 SDS Buffer를 사용한다면 기존의 buffer에 비해서 더 많은 단백질 회수할 수 있을것이고 C18 컬럼으로는 제거되지 않는 SDS buffer는 S-trap을 통해 효율적으로 제거될 수 있을 것이다.

2) Digestion of limited amount samples
1~2 µg의 소량 단일 단백질에서 Buffer를 제거하고 분석해야 할 경우가 있다. Immunoprecipitation (IP)시료가 대표적인 시료이다. 하지만 소량의 단백질의 경우 이 과정에서 단백질이 많이 손실될 수도 있고 때로는 거의 회수가 안되는 경우가 있다. Buffer exchange에 사용되는 TCA-acetone precipation는 소량의 시료에는 적합하지 않다(경험상으로).
이런 소량의 단백질이 실제로 S-trap 어느정도의 효율성을 가지는지 확인해보았다. 이를 위해 2 µg의 standard BSA를 S-trap(SDS buffer 추가)과 In-solution로 각각 digestion하여 결과를 비교하였다(Figure 5). In-solution의 경우 단백질 손실을 최소화하기 위해서 분석전 C18 clean-up을 하지 않았다. 또한 S-trap 분석에서는 1시간, 그리고 In-solution의 경우 overnight 동안 tryptic digestion을 진행하였다.

tryptic digestion후 각각 100 ng 으로 분석하였다. 아래는 각각에서 얻어진 크로마토그램이다(Figure 6). 아래 그림에서 보듯이 두 크로마토그램에서는 상이한 차이를 보이지 않았다.

소량의 단백질의 경우 시료손실에 대한 위험이 많은데 S-trap는 이러한 문제를 해결해 줄것이라 생각한다.
또한 IP 시료의 경우 현재까지는 SDS-PAGE 를 이용하여 buffer를 제거하였지만 S-trap을 사용할 경우 많은 수의 시료를 빠른 시간내에 처리할 수 있을것이라 생각한다.
S-trap의 효율성에 대해 확신을 가진후 현재는 실제 분석서비스에 적용하고 있다.
'프로테오믹스(단백체학)' 카테고리의 다른 글
| GL-Tip GC (Carbon Spin-column) / Pierce™ Graphite Spin Columns 을 이용한 펩타이드 정제방법 (0) | 2020.04.19 |
|---|---|
| 10-Plex TMT 에 100 µg이상의 단백질 Labeling 하기 (400 µg까지 확인) (0) | 2020.04.19 |
| Easy nLC and Dionex LC 의 Valve Stator의 Scratch 현상 확인하는 법 (0) | 2020.04.17 |
| BSA를 이용한 Disulfide-linked Peptides 검출법 (0) | 2020.04.17 |
| 단일 In-gel 밴드에서 99% Sequence coverage 얻기 (0) | 2020.04.16 |




댓글