시료를 분석하다 보면 결과 생각만큼 좋지 않을때가 있다. 가끔씩은 Background 크로마토그램만 나올 때가 있어서 당황스럽니다. 이럴때는 분석의뢰자들에게 결과를 보여주기가 망설여지기까지 한다.
특별히 장비의 이상이 있었다면 모를까 이유를 알수 없을때는 더 그렇다. 시료 자체의 문제라고 말하면 의뢰자로써는 수긍하기가 어렵고 오히려 기분이 나쁠수가 있기 때문이다. 처음부터 양이 적은 시료 (특히 매우 옅은 진하기의In-gel band) 의 경우 이런 일들이 자주 발생한다.
만약 분석전처리 및 장비의 이상이 없었다는것을 보여줄수있는 데이타가 있으면 대화하기가 수훨해질것이며 필요하지 않는 죄책감을 느낄필요도 없다.
이를 위해서 보통 두가지 방법을 사용한다
1) Trypsin Autolysis Products
단백질의 양을 예상할수 없을때는 대략의 양을 결정한후 1:20~50정도의 비율로 trypsin을 추가한다. 하지만 예상한 단백질 양보다 실제 양이 훨씬 적을 경우 trypsin의 상대적인 비율이 증가하게 된다. 이 경우 trypsin의 autolysis의 효과가 커지게 된다. 이런 시료의 경우 trypsin autolysis peaks들이 상당히 높은 감도로 검출된다.
대표적인 trypsin autolysis product 는 여기를 참조하면 된다. 대표적인 피크는 m/z 421.7589 (z=2, VATVSLPR)이다.
만약 크로마토그램상에서 펩타이드의 피크들이 거의 보이지 않을때 실망하지 말라!. 만약 autolysis 피크가 제대로 보인다면 그것은 최초에 예상한 단백질의 양 자체가 실제 양보다 적었다는 의미가 될 수 있다. 즉 실험상의 문제라기 보다는 질량분석기가 측정할 수 있는 감도 이하의 단백질 양이 었을 가능성이 높다. 또한 trypsin 처리 이후의 전처리과정 과 질량분석 과정에서 시료의 손실이 없었다는것을 말해준다. 만약 상당량의 시료 손실이 있었다면 이 피크들도 나오지 않아야 된다.
아래그림은 실제로 의뢰자의 시료를 분석한 예이다. 의뢰자는 gel-band 안에 2ug 이상의 단백질이 있을것이라고 예상했다(하지만 밴드는 아주 희미했다). 실제 분석을 하고나니 전형적인 background 피크들만 보였다 (위)
이 데이타에서 tryspin autolysis peak (m/z 421.7589을 XIC로 확인해볼 결과 아주 큰 피크로 나타났다. (아래)

2) Synthetic peptide standard Mixture (PicoSURE, New Objective)
한가지 더 수행하는 방법은 질량분석기 주입전 바로 synthetic standard peptides를 spiking 하는것이다. 여러 회사에서 많은 종료의 standard peptide mixture 를 판매하고 있다. 하지만 일부는 heavy isotope 형태라서 가격이 비싼 경우가 많다. 작년에 우연히 New Objective 사의 PicoSURE 을 보고 주문하여 시험을 해보았다.
PicoSure Test Standard Equimolar mixture of 7 synthetic peptides, 100 pmol (P/N PS-STND-1).
한 Via당 7개의 펩타이드가 각 100 pmol 포함되어 있으며 2019년 1월 기준으로 62불이다. . 아래표 회사의 웹사이트에 있는 는 펩타이드 정보이다. 보통 한번 시료 주입당 20fmol 을 사용한다. (총 5000번 정도 사용가능)
아래는 회사 웹사이트에 나와 있는 정보이다.


Standard mixture는 데이타 베이스 검색을 필요로 하지 않고 그냥 Qual Browser상에서 MS1의 감도만 체크하는 편이다. 그래서 많은 양을 사용할 필요도 없다. 보통 10~20fmol (on-column)이면 충분하다.
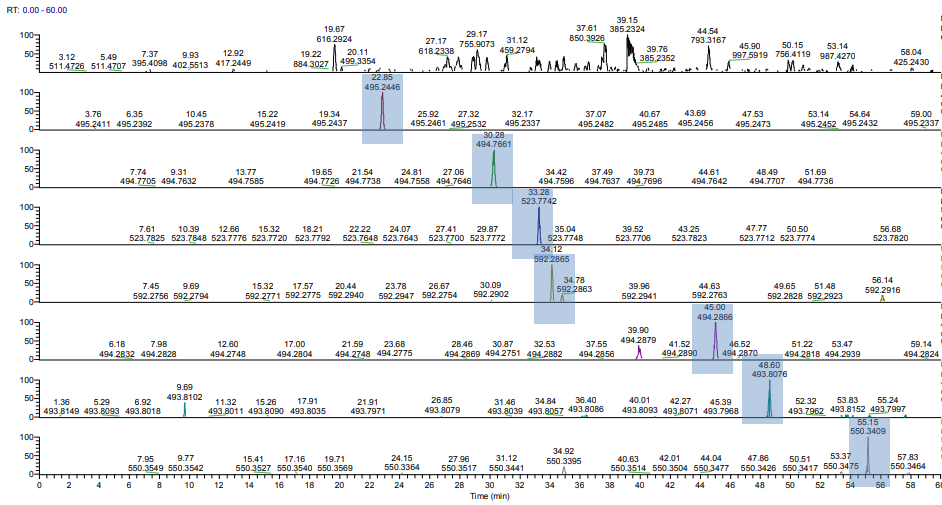
테스트를 위해서 50fmol를 주입하여 결과를 얻었다. 크로마토 그램과 각 펩타이드의 XIC는 아래와 같다.


한가지 특이한 점이 있다면, 각 펩타이드는 동일한 양으로 혼합되어 있음으로 이론적으로는 상대적인 감도는 크게 차이나지 않아야 한다. (물론 펩타이드 조성에 따라 감도는 다를수있음). 하지만 그림에서 보면 뒤쪽에서 용리되는 피크들의 상대적인 감도가 크게는 100배 정도 낮다.
시료는 사전 혼합되어 있음으로 시료준비과정에서 특정한 펩타이드만 손실이 생길수는 없다.
본사에 문의하여 몇번 이야기를 나누고 새로운 vial을 받았지만 결과는 동일했다. 본사쪽 분석에서는 이상이 없었다고 하니 더 이상 문제제기는 하지 않았다.
그럼에도 불구하고 이 시약은 Spiking용으로 괜찮은것같다. 일단 저렴한것이 큰 장점이다. 설령 모든 펩타이들이 검출되지 않더라도 잘 검출된 몇개의 펩타이드만으로 Spiking 역활을 충분히 할수 있기 때문이다.
이 두가지 방법을 통해 자칫 의뢰자들과 분쟁이 될수 있는 일을 피할수 있었다. 이 두 가지 데이타를 제시하면 분석의뢰자는 대체적으로 수긍을 하는 편이며 다음 분석때는 더 많은 양의 시료를 제공한다.
관련글
Promega 6 × 5 LC-MS/MS Peptide Reference Mix 사용후기
Promega 6 × 5 LC-MS/MS Peptide Reference Mix 사용후기
시스템 QC 용으로 Promega사의 6 × 5 LC-MS/MS Peptide Reference Mix 를 구매하여 테스트 하였다. 일반적으로 System Suitability 체크용 Standard 펩타이드의 경우 서로 동일한 농도를 가지는 서로 다른 펩타이..
proteomicstechnology.tistory.com
장비상태 확인을 위해 Standard BSA를 이용한 Unscheduled PRM 분석법
장비상태 확인을 위해 Standard BSA를 이용한 Unscheduled PRM 분석법
일반적으로 장비상태 점검을 위한 BSA 분석은 Data Dependent Acquisition (DDA) 방법을 이용하다. 이를 통해 검출가능한 모든 펩타이드를 검출하고 이에 따라 BSA의 Sequence coverage 및 검출된 펩타이드를 점
proteomicstechnology.tistory.com
Pierce™ HeLa Protein Digest Standard (P/N 88329)로 장비상태 확인하는 방법
'프로테오믹스(단백체학)' 카테고리의 다른 글
| Thermo TSQ Altis™ Triple Quadrupole 를 이용한 프로테오믹스 분석 (0) | 2020.04.12 |
|---|---|
| Spike-in Proteins for quantitative proteomics (Ovalbumin) (2) | 2020.04.11 |
| Byonic™ 와 Proteome Discover의 결합으로 검출단 펩타이드수 증가시키는 방법 (0) | 2020.04.09 |
| ProteinProspector 를 이용한 특정 Enzyme에 대한 단백질의 예상 절단 펩타이드 확인하는 법 (0) | 2020.04.09 |
| 장비상태 확인을 위해 Standard BSA를 이용한 Unscheduled PRM 분석법 (0) | 2020.04.08 |




댓글