대학원 그리고 박사후 연구원동안 혈액에서의 바이오마커를 검출하는 일을 하였습니다. 혈액은 가장 쉽게 확보할수 있는 생체시료이기에 진단용으로 아주 유용합니다. "한방울의 혈액"으로 많은 질병을 진단할수있는것이 많은 연구자들이 가지는 목표일것입니다
혈액 특히 Plasma 나 Serum을 프로테오믹스로 분석하는데 있어서 실제 실험실에서 겪는 어려운점을 적어볼까 합니다.
소수의 단백질이 혈액단백질의 거의 90% 이상을 차지함으로 나머지 중요한 단백질이 검출되지 어렵다는 점은 대부분 알고 있을것같습니다.
1. High abundant proteins 의 양적 차이에 따른 low abundant proteins의 단백질양의 큰 변화
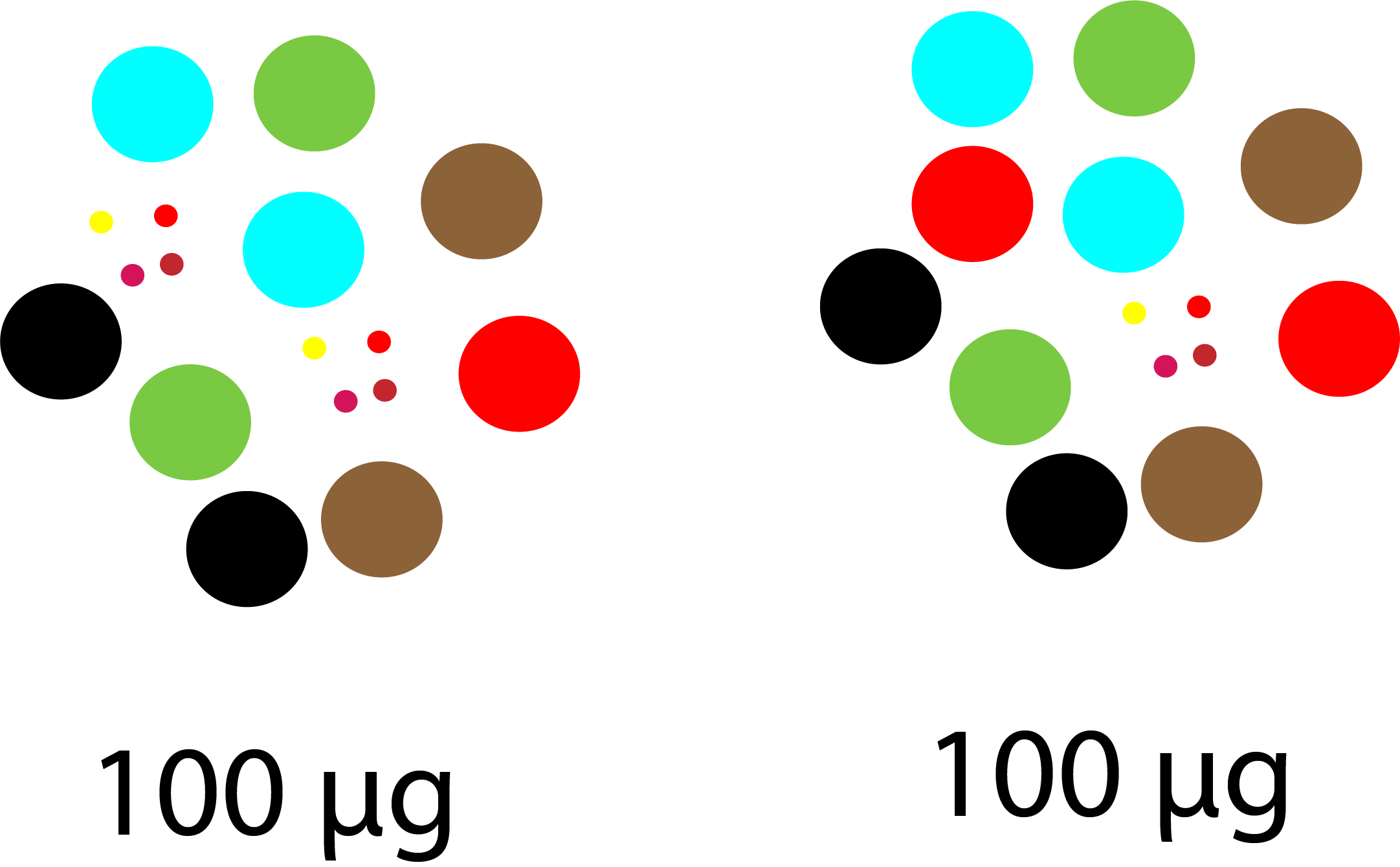
적은 수의 High abundant proteins (e.g, Albumin)의 함량이 매우 높기 때문에 이러한 단백질의 양이 조그만 변해도 전체 양에 큰 영향을 주게 됩니다. 정량분석을 위해서는 동일한 양으로 시작합니다. 예를 들면 시료당 100ug으로 시작합니다. 아마 여기세 90%이상은 high abundant proteins일것이고 나머지 몇천개의 단백질의 합이 10%도 되지 않을것입니다. 즉 단백질당 실제 양은 극미량이게 됩니다. 만약 high abundant proteins의 약이 아주 조금만 변화한 시료를 100ug을 취하게 되면 이 시료안에 있는 low abundant protein들의 상대적인 양은 아주 많이 변화하게 됩니다.
질량분석기를 통해서 차이나는 적은 농도의 단백질이 실제 생체내에서의 변화가 아니라 처음부터 차이나는 양으로 분석을 하게 된 경우입니다.
2. 부정확한 단백질 농도 측정
일반적으로 혈액의 농도는 50~60µg/µL 입니다. 하지만 정량분석을 위해서는 각 시료의 양을 동일하게 해야 됨으로 단백질 농도를 정확히 측정한후 일정 양 (µg)으로 맞추어야 합니다. 하지만 농도측정에서 많은 오류가 생길수 있습니다. Bradford assay등으로 농도를 측정하기 위해서는 고농도의 시료를 dilution을 해야 합니다. 이때 시료마다 정확히 일정량을 취하지 못할 경우가 있습니다. 예를 들면 피펫 팁의 외부에 아주 소량의 혈액이 뭍어서 같이 측정이 될 경우도 농도에 큰 영향을 줍니다.
3. Sticky한 성질에 의한 부정확한 파펫팅
환자나 질병에 따라 혈액시료가 아주 sticky한 경우가 있습니다. 이럴 때는 핏펫팅에서 더더 욱 오류가 발생합니다. 위에서 언급한 데로 단백질 농도측정, dilution등의 과정에서 오류가 발생합니다. 그래서 특히 혈액 시료의 경우 피펫팅할때 매우 조심을 해야 합니다. 피펫 팁을 혈액시료 깊숙이 넣지 않고 최대한 팁 끝으로만 시료를 취해야 합니다. 혈액과 팁이 최소한으로 만나야 합니다.

4. Depletion of High abundant proteins
관련된 많은 논문이들이 나와있습니다. 초창기때 Agilent사의 MARS 컬럼을 HPLC에 장착하여 High abundant proteins을 제거하였습니다. 요즘도 kit 형식으로 여러 Vendor에서 구매할수 있습니다. High abundant proteins을 제거하지 않으면 검출이 되지 않는 low abundant proteins이 존재합니다. 하지만 depletion 과정은 완전한 재현성이 확보된것이 아닙니다. High abundant proteins을 정확히 몇 % 제거하는것이 아니고 % 이상 제거한다고 되어있습니다. 즉 시료마다 제거되는 양이 조금씩 다를수 있습니다. 이 경우 앞에서 설명한것 처럼 high abundant proteins의 양이 조금만 다르게 제거되더라도 동일한 양 (µg)안에 존재하는 low abundant proteins의 상대적인 양은 확연히 달라집니다. 동일한 두 시료를 kit를 이용하여 high abundant proteins을 제거한후 각각 100ug을 취하여도 실제 low abundance proteins,의 양은 다를수 있습니다. 또한 Albumin과 같은 high abundant proteins은 low abundant proteins과 결합하여 데리고 다니는 기능도 있습니다. 즉 high abundant proteins이 제거될때 동시에 low abundant protein은 비일괄적으로 제거될수 있습니다.

5. ESI ion suppressions of low abundant proteins
ESI의 경우 가장 큰 피크를 100으로 두고 나머지는 그에 비례하는 값으로 측정이 됩니다. 만약 동일한 펩타이드 A가 주입되더라도 같이 용리되는 다른 펩타이드의 양이 매우 다를 경우 펩타이드 A의 상대적인 양은 달리질수 있습니다. High abundant proteins에서 생성된 펩타이드는 전체 크로마토그램에서 대부분을 차지 합니다. 여기에서도 high abundant peptide 피크들의 높이가 조금만 달라져도 낮은 농도의 펩타이드의 높이는 크게 차이가 나게 됩니다. 즉 정량분석값에 큰 영향을 줍니다. 또한 Data-dependent acquisition 분석에서는 high abundant protein의 펩타이드들에 의해서 적은 양의 단백질의 펩타이드는 존재함에도 불구하고 MS2가 수행이 되지 않을수가 있습니다. 즉 DB 검색시 찾지 못하게 됩니다. 혹은 여러 시료를 분석시 경우에 따라서는 검출이 되고 안될수 있습니다. 이것을 DB 검색으로 정량분석을 하게 되면 해당 단백질이 크게 변한것으로 나타나게 됩니다.

6. 적은 수의 펩타이드 검출에 따른 낮은 정량분석 신뢰성
데이타를 분석후 검출된 high abundant proteins의 경우 매우 많은 수의 펩타이드가 검출이 됩니다. 하지만 나머지 단백질은 한개 혹은 두개의 펩타이드만으로 검출이 된 경우가 많습니다. 이렇게 한 두개의 펩타이드 검출로 얻어진 단백질의 정량분석은 신뢰성이 매우 낮습니다. 또한 피크 높이도 매우 낮기 때문에 정확한 정량분석값이 측정이 되지 않습니다. 결과를 보면 마치 많은 단백질이 상당히 많이 변화한것 처럼 보입니다. 기뻐하기는 이릅니다. 이러한 오류를 보정하기 위해서는 최대한 많은 biological replicates를 사용하여 통계분석을 해야 됩니다. 또한 특정 수의 이상의 펩타이드로 검색된 단백질만을 결과에 포함시킬수도 있습니다. 하지만 이럴경우 전체 단백질수가 급격히 줄어 들게 됩니다. 실험자 입장에서는 고민이 됩니다. 펩타이드의 수를 증가시키기 위해서 사전 분획을 할수도 있습니다. 이것은 보다 많은 펩타이드를 검출하는데 도움이 됩니다. 하지만 분획을 하게 되면 결국 high abundant proteins에 해당하는 펩타이드만 더 많이 검출되는 경우도 생깁니다. 노력만큼 얻는것이 없습니다. 또한 분획후 정량분석을 하게 되면 분획과정에서 오류를 보정하기가 어렵습니다.
관련글
혈액단백질 (Plasma & Serum)의 프로테오믹스 분석의 어려운점
Pierce™ Top 12 Abundant Protein Depletion Spin Columns 으로 혈액 단백질 검출하기
Pierce™ Top 12 Abundant Protein Depletion Spin Columns 으로 혈액 단백질 검출하기
혈액 단백질 분석에 있어서 Albumin과 같은 high-abundant proteins을 제거하는 방법이 여러가지가 있습니다. 한때 Agilent 의 Multiple Affinity Removal Column (MARC) 을 사용했었습니다. 요즘은 혈액 단백질..
proteomicstechnology.tistory.com
많은 수의 human plasma 시료의 정량분석을 위한 전처리 방법
많은 수의 human plasma 시료의 정량분석을 위한 전처리 방법
Plasma 시료전처리의 어려움 Plasma 시료 분석 의뢰는 일반 분석에 비해서 많은 수의 시료를 접수합니다. 상대적으로 채취가 쉬워서 일수도 있고 의미있는 단백질을 찾기 위해서 여러 환자로 부터
proteomicstechnology.tistory.com
'프로테오믹스(단백체학)' 카테고리의 다른 글
| DSSO (disuccinimidyl sulfoxide) Crosslinking 펩타이드 분석을 위한 Orbitrap Fusion MS3 Method 설정 (0) | 2021.03.23 |
|---|---|
| TMT 정량분석에서 Proteome Discoverer의 Co-isolation threshold 값의 효과 (0) | 2021.03.22 |
| DSSO (disuccinimidyl sulfoxide) Crosslinking (XL-MS) 펩타이드 분석 (BSA+Cytochrome C) (0) | 2021.03.17 |
| Nano LC 시스템에서 trap column의 셋팅과 역활 (2) | 2021.03.17 |
| Orbitrap Fusion에서 Intensity Threshold 설정에 따른 펩타이드 검출차이 (1) | 2021.03.10 |




댓글