Glycopeptides는 C18 Reverse-phased Chromatography에서 어떻게 상호작용을 할까요?
이것을 이해하면 수작업을 통해 glycopeptides 스펙트럼을 분석하는데 도움이 됩니다.. Glycopeptides 분석 프로그램이 없던 시절에는 수작업으로 분석을 했었습니다. 사실 지금도 괜찮은 프로그램은 그다지 없습니다.
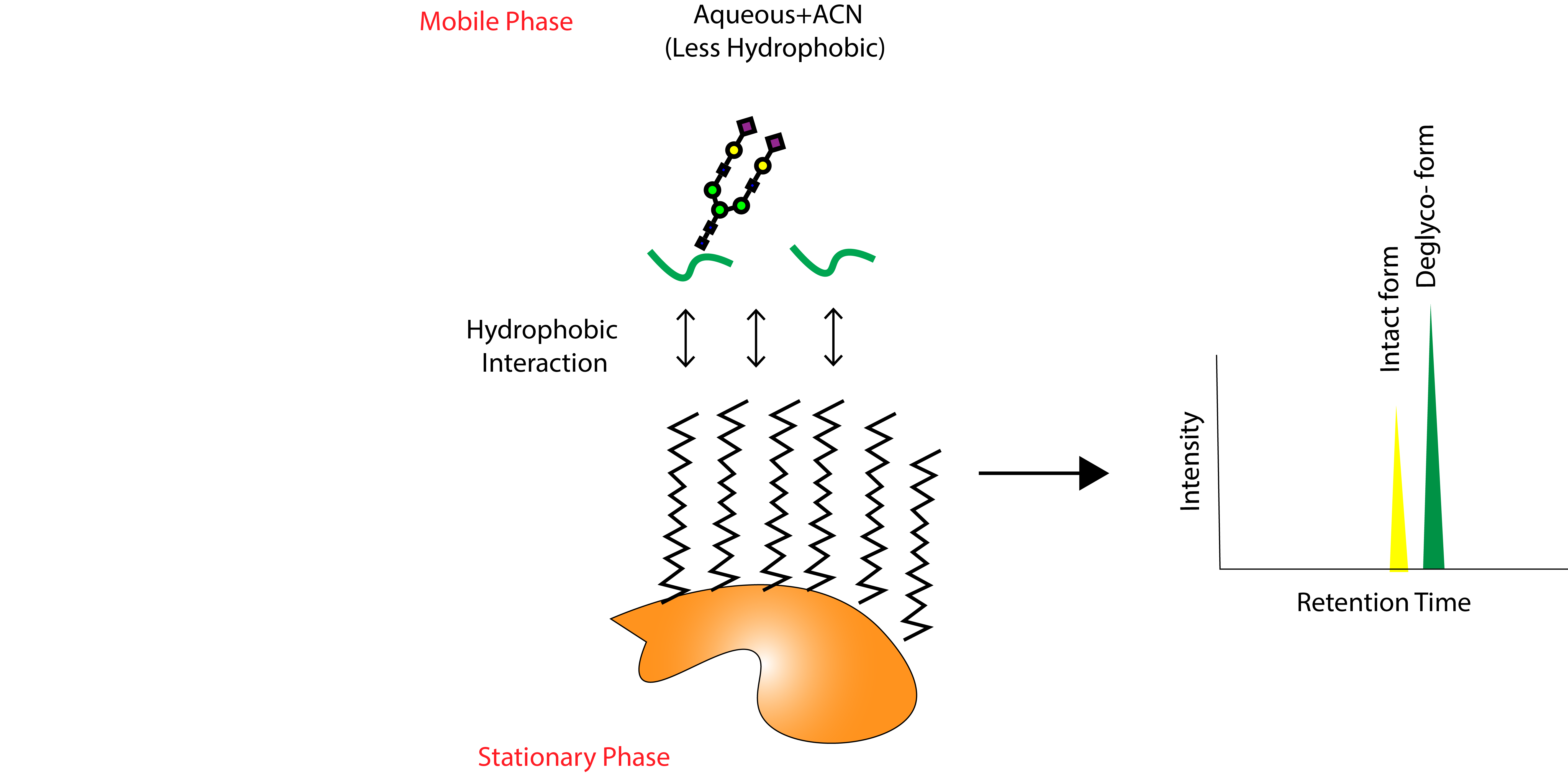
가장 중요한 원리는 C18 Reverse-phased chromatography에서는 동일한 펩타이드 Backbone을 가지고 있다면 glycosylation 여부와 상관없이 유사한 retention time을 가집니다. 그 이유는 hydrophobic 정지상(C18)과 실제적으로 상호작용하는 부분은 glycan쪽이 아닌 hydrophobic한 펩타이드 부분이기 때문입니다. 유유상종의 원리입니다. Hydrophilic한 glycan 구조는 hydrophobic한 C18을 싫어해서 이동상쪽으로 방향을 돌립니다.
즉 A라는 펩타이드 있다면, glycan이 없는 A, 다양한 종류의 glycan(G)이 붙어 있는 A-G1, A-G2, A-G3...등등이 거의 유사한 시간대에 한꺼번에 용리됩니다. 수만개의 피크중에서 glycopeptides를 찾는데 단서를 줍니다.
실제 데이타를 보겠습니다.
Tryptic digestion and PNGase-F Treatment of Hatogloban standard
혈액단백질중 대표적인 당단백질인 Haptoglobin standard를 Sigmaldrich 에서 구매하였습니다 (H3536-1MG)
분석을 위해서 단백질을 tryptic digestion 한후 2개로 나누어서 하나는 PNGae-F 를 추가로 처리하였습니다. PNGase-F는 Asn에 붙어 있는 N-linked glycan을 선택적으로 제거합니다. 그리고 Asn(N)은 Asp(D)로 바뀌게 되는 deamidation (+0.98Da)이 일어나게 됩니다.
관련글 보기 PNGase-F 효소로 N-linked glycopeptides 위치 찾기

Glycan이 붙어 있는 펩타이드는 분자량이 매우 큽니다. . 그래서 보통 높은 전하값(+3. 4+. 5+)과 함께 높은 m/z 영역에서 나타납니다. 그래서 일반 펩타이드 분석시 사용되는 Full scan 영역보다 높은 scan range로 분석해야 합니다. 아래는 두 시료를 두개의 Full scan 영역 (mz 3800-1200 vs mz 800-1800)에서 얻어진 스텍트럼입니다. 패턴이 조금씩 다른것을 볼 수 있습니다.

Identification of N-liked glycosylation site
먼저 PNGase-F 처리한 결과를 Database 검색을 하여 N-linked sites를 찾습니다. 아래 테이블은 Haptoglobin 의 대표적인 N-linked site를 가지는 펩타이드 (VVLHPNYSQVDIGLIK) 입니다. Asn에 glycosylation이 되어있었던 펩타이드는 PNGase-F 처리후 Glycan이 제거된후 Deamidation이 되었으며 glycosylation이 되어있지 않은 펩타이드는 원래의 형태로 검출되었습니다.

N-linked Glycopeptides of VVLHPNYSQVDIGLIK
N-linked glycan 구조중 대표적인것을 선택해 보겠습니다. 구조는 아래와 같습니다 (m/z 1139.8691, 3+)

실제 데이타에서 아래와 같이 1.13 ppm 정확도에서 피크가 보입니다.

Extracted Ion Chromatogram of 3 different peptide forms
VVLHPNYSQVDIGLIK, VVLHPN(deamidation)YSQVDIGLIK, VVLHPN(Glycosylation)YSQVDIGLIK 에 해당하는 extraction ion chromatography는 아래와 같습니다. VVLHPNYSQVDIGLIK 는 18.76분 ,VVLHPN(deamidation)YSQVDIGLIK 는 19.23 분 , VVLHPN(Glycosylation)YSQVDIGLIK는 17.63분에서 용리되었습니다. 세개의 펩타이드가 2분내에서 다 용리되었습니다. VVLHPNYSQVDIGLIK에 대표적인 glycan 이 붙은 형태가 glyan이 붙어있지 않은 순수한 VVLHPNYSQVDIGLIK와
유사한 시간대에 용리됨을 알 수 있습니다.

PNGase-F를 처리하지 않은 Haptoglobin의 스펙트럼중에서 17.5분에서 20분 사이의 Full scan을 보면 높은 전하를 가지는 피크들이 많이 분포되어있음을 알 수 있습니다. 이러한 피크들은 VVLHPNYSQVDIGLIK에 다양한 glycan이 붙은 형태의 것임을 예상 할 수 있습니다.

위의 내용과 같이 PNGase-F를 처리하여 펩타이드의 backbone 의 retention time을 알게 되면 이 펩타이드에 다양한 glycan이 붙은 여러개의 N-linked glycopeptide들을 찾아 낼 수 있습니다.
관련글
FAIMS를 이용하여 선택적으로 N-linked glycopeptides 검출하는 방법
In-source fragmentation (CID) for N-linked peptide Characterization
In-source fragmentation (CID) for N-linked peptide Characterization
앞에서 In-source fragmentation 에 대한 설명을 하였습니다. 이번에는 In-source fragmentation 을 N-linked glycopeptide 분석하는데 있어서 어떻게 적용할수 있는지 알아보겠습니다. 이전에 사용했던 mAb 의..
proteomicstechnology.tistory.com
Monoclonal Antibody (mAb)에서 Intact N-linked glycopeptides 분석
Monoclonal Antibody (mAb)에서 Intact N-linked glycopeptides 분석
Monoclonal Antibody (mAb)에서N-linked glycopeptides를 분석을 해보았습니다. 제약회사에서는 mAb의 glycopeptides에 대한 분석이 중요하다고 알고 있습니다. 직접 실험을 해보지는 않았지만 간접적으로 나마 간
proteomicstechnology.tistory.com
HCD fragmentation 과 Proteome Discoverer 및 Byonic 을 이용한 O-linked glycopeptide 분석
Glycopeptides 구조분석을 위한 stepped NCE fragmentation
Byonic™ – (Protein Metrics)로 N-linked glycopeptides 분석하기
수작업으로 N-linked glycopeptides 구조분석하기
'프로테오믹스(단백체학)' 카테고리의 다른 글
| 수작업으로 N-linked glycopeptides 구조분석하기 (0) | 2020.06.30 |
|---|---|
| PNGase-F 효소로 N-linked glycopeptide 위치 찾기 (0) | 2020.06.28 |
| [초보생물통계] T-TEST (t-검정)에 대해서 알아보기 (0) | 2020.06.22 |
| (초보통계학) Normality (정규성)와 분산의 동질성(Homogeneity of variance) 확인 하는 법 (0) | 2020.06.22 |
| p 값에 대해 간단한 해석 (0) | 2020.06.22 |




댓글