Monoclonal Antibody (mAb)에서N-linked glycopeptides를 분석을 해보았습니다. 제약회사에서는 mAb의 glycopeptides에 대한 분석이 중요하다고 알고 있습니다. 직접 실험을 해보지는 않았지만 간접적으로 나마 간단히 실험해보았습니다. 차후에 분석서비스에 적용할수 있을지 확인해 보기로 했습니다. 시료는 Waters에서 standard mAb를 구매하였습니다. Intact protein 과 tryptic peptides 형태로 각각 구매할수 있습니다. 두개를 구매했으나 아무래도 tryptic digestion이 된 시료가 더 편한것 같습니다. 관련 정보는 아래와 같습니다
Intact mAb mass check standard proteins ( P/N 186009125)
mAb tryptic digestion standard (P/N 186009126)
https://www.waters.com/webassets/cms/support/docs/720006359en.pdf
해당 펩타이드 sequence는 아래와 같습니다.

이론적인 tryptic peptide 리스트는 아래와 같습니다

아래는 직접 분석한 100ng에 해당하는 크로마토그램입니다.
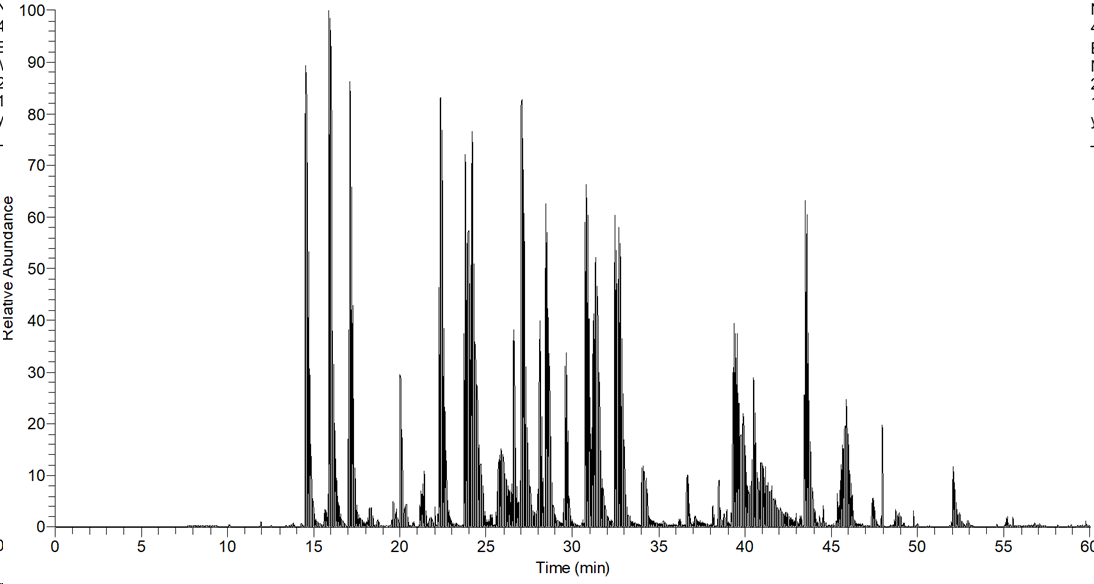
Raw 파일을 Proteome Discoverer로 검색을 하였습니다. 아래와 같은 여러 IgG 형태가 검출되었습니다.

Intact glycopeptide 구조분석을 위해서는 sequence중 glycosylation이 되어 있는 tryptic peptide를 찾아야 합니다. 이전 글에서 썼듯이, intact glycopeptides를 수작업으로 분석하기 위해서는 전체 크로마토그램중에서 그들이 어디에서 용리되는지 알아야 합니다.
이전글] Glycopeptides 구조분석을 위한 stepped NCE fragmentation
이전글] 수작업으로 N-linked glycopeptides 구조분석하기
이를 위해서는 PNGase-F를 처리하여 펩타이드 backbone의 용리시간을 알아야합니다. 하지만 다행히 이미 정보를 알고있으며 더 나아가 해당펩타이드 EEQYNSTYR (m/z 595.2596)가 검출되었습니다.
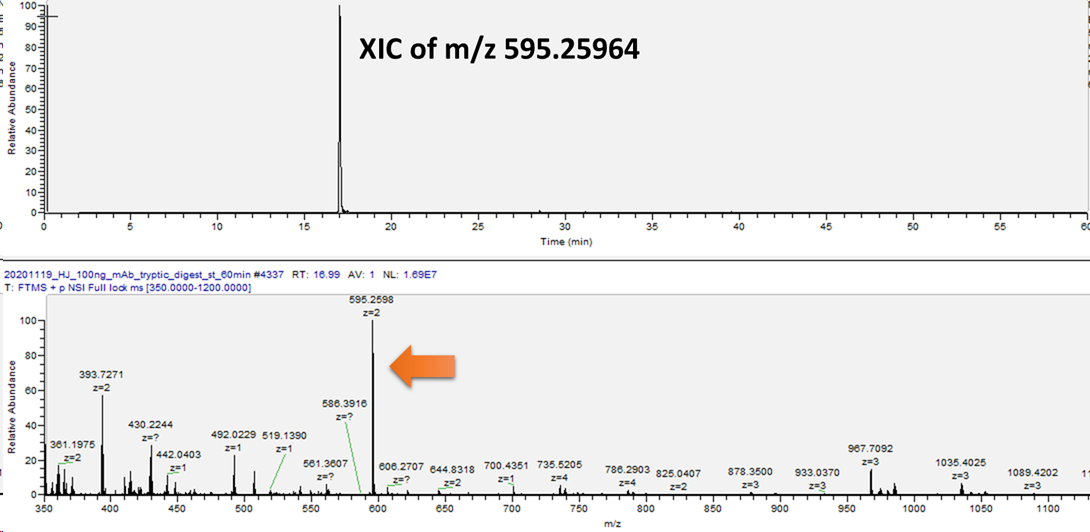
즉 이 근처에서 많은 glycosylation form이 용리될것이라고 예상할수 있습니다. 완전 노가다 수준입니다. 다행히 문헌에서 이미 검출된 결과가 있어서 조금은 쉽게 진행할수 있었습니다. 아래는 수작업을 통해 분석한 Intact N-linked glycopeptides 스펙트럼입니다.




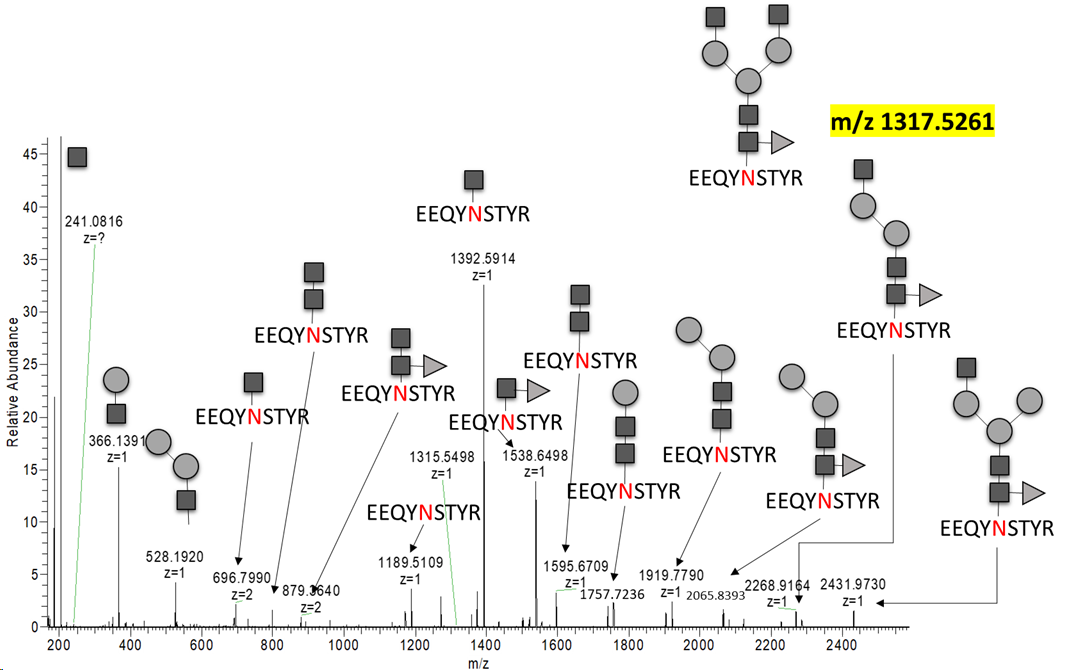
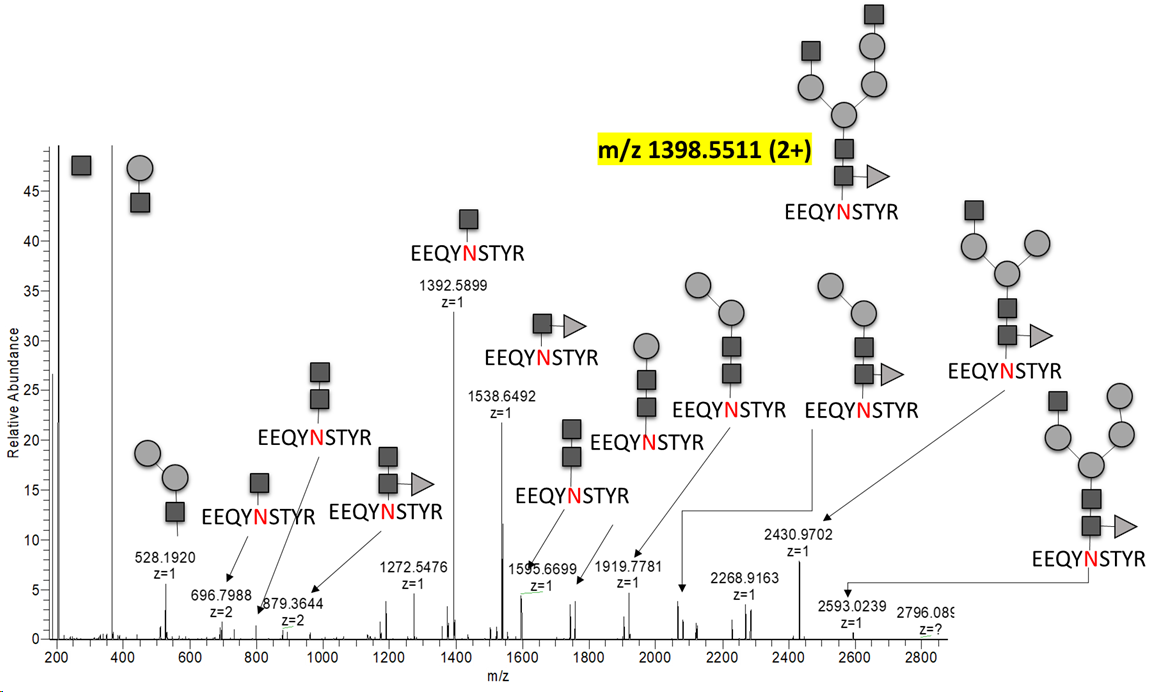
mAb에서의 분석이 특별히 다른 단백질에 비해서 어려운점은 없는것 같습니다. 수작업이 많이 들어간다는 점에서는 동일한것 같습니다
관련글
FAIMS를 이용하여 선택적으로 N-linked glycopeptides 검출하는 방법
In-source fragmentation (CID) for N-linked peptide Characterization
In-source fragmentation (CID) for N-linked peptide Characterization
앞에서 In-source fragmentation 에 대한 설명을 하였습니다. 이번에는 In-source fragmentation 을 N-linked glycopeptide 분석하는데 있어서 어떻게 적용할수 있는지 알아보겠습니다. 이전에 사용했던 mAb 의..
proteomicstechnology.tistory.com
Monoclonal Antibody (mAb)에서 Intact N-linked glycopeptides 분석
Monoclonal Antibody (mAb)에서 Intact N-linked glycopeptides 분석
Monoclonal Antibody (mAb)에서N-linked glycopeptides를 분석을 해보았습니다. 제약회사에서는 mAb의 glycopeptides에 대한 분석이 중요하다고 알고 있습니다. 직접 실험을 해보지는 않았지만 간접적으로 나마 간
proteomicstechnology.tistory.com
HCD fragmentation 과 Proteome Discoverer 및 Byonic 을 이용한 O-linked glycopeptide 분석
Glycopeptides 구조분석을 위한 stepped NCE fragmentation
Byonic™ – (Protein Metrics)로 N-linked glycopeptides 분석하기
수작업으로 N-linked glycopeptides 구조분석하기
'프로테오믹스(단백체학)' 카테고리의 다른 글
| Histone 의 Isobaric PTM Peptides 분석하기 (0) | 2020.12.26 |
|---|---|
| Herceptin, monoclonal Antibody 의 Disulfide bond 펩타이드 분석법 (2) | 2020.12.21 |
| 특정단백질 검출시 단일 단백질 fasta로 검색할때 주의할점 (0) | 2020.12.10 |
| HPLC 이동상 (buffers)의 오염으로 인한 background peaks (0) | 2020.12.03 |
| Histone Propinolylation을 통한 bottom-up proteomic analysis (0) | 2020.12.01 |




댓글