Nano column 의 상태를 정확히 점검하기는 쉽지 않습니다. 좋지 않은 시료로 인해서 컬럼이 막히지 않는한 매번 체크해서 상태를 확인할수가 없습니다. 그러므로 교체시기를 정확히 알기는 어렵습니다.
실험실마다 BSA 나 HeLa standard등으로 QC run을 수행을 하여 시스템의 상태를 점검합니다.
하지만 Nano HPLC-trapcolumn-nano column- Mass spectrometry가 서로 연결되어 있기 때문에 감도가 떨어진 것만으로 컬럼의 문제라고 말할 수도 없습니다. 또한 Trap 컬럼을 사용하는 경우에는 Trap 컬럼의 문제인지도 확인하기가 쉽지 않습니다. 일단 모든 것이 정상이면 컬럼도 상태가 좋다고 말할수 있겠지요. 하지만 문제가 있을 경우 컬럼만의 문제임을 확인하는것이 어렵습니다.
아래와 같이 피크들이 모두 뾰족하게 잘나오면 좋겠지요. (Standard BSA digest 로 LC 장비, 컬럼, 질량분석기 상태확인는 법). 실험실에서 직접 만든 컬럼임에도 아주 좋은 피크모양을 얻었습니다.
보통 아래와 같은 방법으로 컬럼상태를 진단합니다.
컬럼을 제외한 모든 것이 정상이라고 가정할 때 (사실 이것을 확인하는 과정이 더 어렵습니다)
1) 압력이 상당히 높이 올라갔을 때
새로운 컬럼을 장착후 equibribum이후 초기 상태에서 압력을 기입해 놓습니다. 일반적으로 새 컬럼을 장착한후 몇 번 실험을 하게 되면 압력이 약간 더 올라간 후 일정해지는 경향이 있습니다.. 압력이 급격히 올라가면 컬럼이 막히기 시작하는 시점입니다. 시료는 컬럼 끝에서부터 접촉하기 때문에 컬럼 끝에서 더러운 시료들이 모여서 압력이 올라가는 경우가 있습니다. 또한 컬럼의 Tip의 내경은 매우 작기 때문에 이 Tip끝이 막혀서 압력이 올라가는 경우가 있습니다. 실험실에서 packing한 컬럼이라면 컬럼 끝을 약간 절단하면 압력이 내려가는 경우가 있습니다. 또한 Tip이 막혔을 경우 라이터로 살짝 확장 시켜주게 되면 압력이 떨어지는 경우가 있습니다. 하지만 고가의 컬럼이나 컬럼 tip의 경우 오히려 컬럼에 손상을 줄 수 있기 때문에 가장 마지막 단계에서 하는 것이 좋습니다.
LC troubleshooting) 갑자기 펩타이드가 빨리 혹은 늦게 용리되는 이유 (tistory.com)
2) 컬럼과 Spray tip이 일체형일경우 높은 전압에서도 bubble이 없어지지 않을 때
보통 좋은 tip의 경우 1.6~1.8 kV에서 분석을 합니다. 2.0 kV이후에도 Spray가 좋지 않으면 교체할 시기가 다가오는 증상입니다. 점검은 분석초기 조건 즉 BufferB의 조성이 5% 이내에서 수행합니다. 보통 펩타이드는 Buffer B의 조성이 5~30%에서 용리됩니다. 이 조성에서 Spray가 아주 잘되어야 합니다. 실험실에서 직접만든 컬럼의 경우 2.0 kV이상에서 실험을 해야 되는 경우가 있습니다.
3) 펩타이드의 피크의 모양이 넓어질 때
모든 피크를 모두 체크하기는 불가능합니다. 보통 처음 중간 끝에 나오는 대표적인 피크들을 정해서 피크모양을 이전 결과와 비교합니다. 여기에는 아주 주관적인 의견이 많이 반영됩니다. 짧은 gradient에서는 피크들이 상대적으로 좋아보입니다. 그러므로 1시간 LC gradient정도의 크로마토그램에서 체크하는것이 좋습니다.
4) Hydrophilic한 펩타이드가 다른 피크들에 비해 높이가 줄어들 때 입니다.
Trap 컬럼에서 아무런 문제가 없다는 가정하에서, 컬럼의 상태가 나빠지면 보통 hydrophilic한 펩타이드들이 잘 결합하지 못합니다. 그러므로 처음에 용리 되는 펩타이드들을 몇개 정해서 비교하면 됩니다 BSA의 경우 NYQEAK에 해당하는 m/z 376.6823(2+)을 체크합니다. 모든 피크들의 높이가 줄어들면 질량분석기의 감도의 문제일 수도 있습니다. 하지만 다른 모든 피크들의 높이는 유사한데 Hydrophilic한 펩타이드의 높이가 줄어든다면 컬럼의 결합력이 떨어지고 있다는 증거입니다.
아래는 최근에 발견한 내용입니다. 두개의 EasySpray Column (ES902)을 동일한 조건에서 분석하였는데 mz 376.6823(+)에 해당하는 피크가 서로 다른 경향을 보입니다. 첫번째 컬럼의 경우 주입후 바로 용리되고 피크의 높이가 상대적으로 낮습니다. 아마 컬럼의 Efficency가 좋지 않은것 같습니다. 하지만 다른 피크들은 모두 정상적으로 나왔으며 오히려 두번째 컬럼에 비해서 피크의 높이가 높았습니다. 이 경우는 애매한 경우입니다.
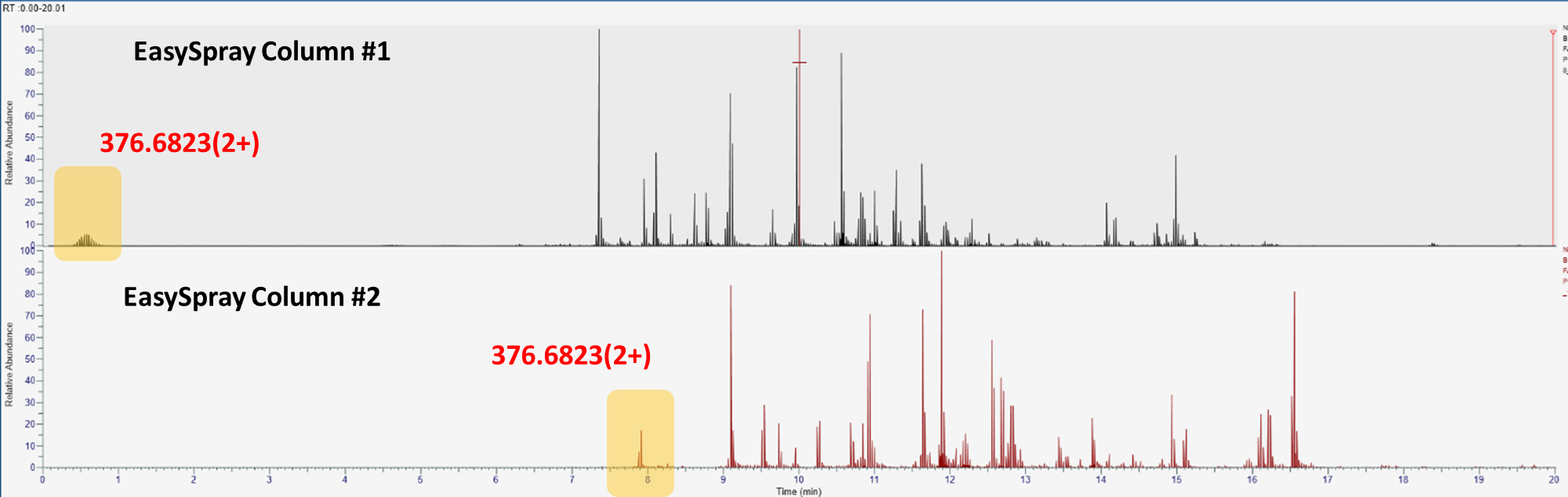
5) Retention time의 변화
이것은 LC장비의 문제일수도 있지만 LC 장비에 문제가 없다고 생각할 경우 컬럼에 이상이 있을 수 있습니다.
컬럼의 상태를 정확히 진단하기 위해서는 오랜 경험이 필요합니다. 앞에서 설명하였듯이 LC 장비의 문제인지 Trap-column의 문제인지, 질량분석기의 문제인지 명확히 아는것이 쉽지 않습니다. 컬럼자체의 문제인지를 명확이 알기 위해서는 앞의 여러가지 요소들에서 문제가 없다는 확신이 있어야 합니다.
대부분 아는 내용이긴 하지만, 컬럼을 제거해야 할 경우가 있다면 flow-rate을 조금씩 낮추어서 압력을 내리도록 해야 합니다.보통 50~100nL 정도씩 flow-rate를 내린후 1~2분 정도 기다립니다. 그리고 압력이 완전히 zero가 되면 컬럼을 제거합니다. 만약 이러한 과정없이 고압력에서 바로 컬럼을 제거하게 되면 고압력 상태에서 압력이 급격히 떨어지게 되어서 컬럼안의 C18들이 요동치게 됩니다. 이 경우 컬럼의 C18들이 뒤로 빠지는 경우가 있으며 또한 packing 상태가 느슨하게 되는 경우가 있습니다.
관련글
PicoSure Test Standard Equimolar mixture of 7 synthetic peptides (tistory.com)
PicoSure Test Standard Equimolar mixture of 7 synthetic peptides
시료를 분석하다 보면 결과 생각만큼 좋지 않을때가 있다. 가끔씩은 Background 크로마토그램만 나올 때가 있어서 당황스럽니다. 이럴때는 분석의뢰자들에게 결과를 보여주기가 망설여지기까지
proteomicstechnology.tistory.com
Trap-column 상태확인하는 방법 (Checking efficiency of trap-columns)
Trap-column 상태확인하는 방법 (Checking efficiency of trap-columns)
Nano analytical column은 보통 실험실에서 in-house 형태로 만들어 사용하지만 상황에 따라서는 미리 만들어진 Trap-column을 구매해서 사용하는 경우도 많습니다. 실험실에서 만들어 쓰는 trap-column의 경우
proteomicstechnology.tistory.com
Promega 6 × 5 LC-MS/MS Peptide Reference Mix 를 이용한 시스템 QC (tistory.com)
Promega 6 × 5 LC-MS/MS Peptide Reference Mix 를 이용한 시스템 QC
시스템 QC 용으로 Promega사의 6 × 5 LC-MS/MS Peptide Reference Mix 를 구매하여 테스트 하였다. 일반적으로 System Suitability 체크용 Standard 펩타이드의 경우 서로 동일한 농도를 가지는 서로 다른 펩타이드
proteomicstechnology.tistory.com
'프로테오믹스(단백체학)' 카테고리의 다른 글
| MSFragger로 QC 시료 빨리 검색하기 (8 min) (0) | 2023.01.01 |
|---|---|
| 상용컬럼의 좋은 분리능-EasySpray Column (ES902) (0) | 2022.12.29 |
| Vials/Tubes 선택 (0) | 2022.12.13 |
| Low-Resolution MS2 스펙트럼에 대한 CHIMERYS의 MS2 tolerance (0) | 2022.12.12 |
| OTOT 와 OTIT DDA에서의 CHIMERYS의 효과 (0) | 2022.12.10 |




댓글