최근 Pharmafluidics사에서 출시된 µPACᵀᴹ컬럼이 논문에서 종종 등장합니다. Nano column을 사용하는데 있어서 가장 큰 단점은 아마 쉽게 막히거나 Retention time의 재현성이 상대적으로 낮다는것입니다. µPACᵀᴹ 컬럼은 회사 홈페이지에서 설명되어 있듯이 시료에 의해서 컬럼이 막히는 일없이 거의 영구적으로 사용할수 있다고 합니다. 이 컬럼은 기존의 beads 형태의 C18 materias도 되어 있지않고 semi-conductor형태로 형성되어 시료에 의해서 막힐수가 없는 형태라고 설명되어 있습니다. 또한 매우 낮은 압력이 걸린다는것입니다. 아마 nano column을 사용하시는 분은 이것이 얼마나 큰 혜택인지 아실껍니다.


µPACᵀᴹ Column Appearance
컬럼 한개의 가격은 3천불이 조금 넘습니다. 하지만 컬럼을 수시로 바꾸어주지 않아도 된다는걸 감안하면 충분한 가치가 있다고 생각이 들었습니다. 일단 컬럼은 아래와 같은 형태입니다. 첫 느낌은 아주 멋있어서 보입니다. 컬럼의 양쪽은 Tubing이 연결된 상태로 출시되며 분리가 불가능합니다. 양쪽에 연결되어있는 union은 분리하면 안됩니다(분리할수는 있지만 추천하지 않습니다). 즉 LC와 Spray tip을 연결하기 위해서는 양쪽 tubing에 추가 연결 튜빙이 필요합니다.

µPACᵀᴹ Grounding
이 컬럼이 기존과 또 다른 하나는 grounding을 해야 한다는것입니다. Spray를 위해서 사용되는 Voltage가 컬럼으로 전달되지 않아야 합니다. Semi-conductor 형태인 컬럼에 Voltage가 전달되면 분리에 큰 영향을 주게 됩니다. 이러한 이유로 컬럼 outlet에 연결된 union에 바로 spray tip을 장착하여 voltage cable을 연결할수 없습니다. 이로 인해 추가적으로 tubing을 연결해야 합니다. 그리고 컬럼과 함께 포함된 grounding cable를 union에 연결후 LC 장비나 질량분석기 장비등에 연결합니다.
µPACᵀᴹ NO Grounding causes a problem
처음에 익숙치 않은 상태에서 컬럼 oulte에 바로 spray tip을 연결한후에 voltage cable을 연결하였습니다. 그리고 grounding 없이 BSA를 분석하였습니다. Peak가 아주 아주 넓게 퍼져 나옵니다. 컬럼의 문제인것으로 생각했으나 컬럼이 charging이 된것입니다. 다시 분석하기 위해서는 24시간 정도 방전(?)을 시켜야 합니다.(업체 조언)

Configuration (Direct connection of a spray tip)
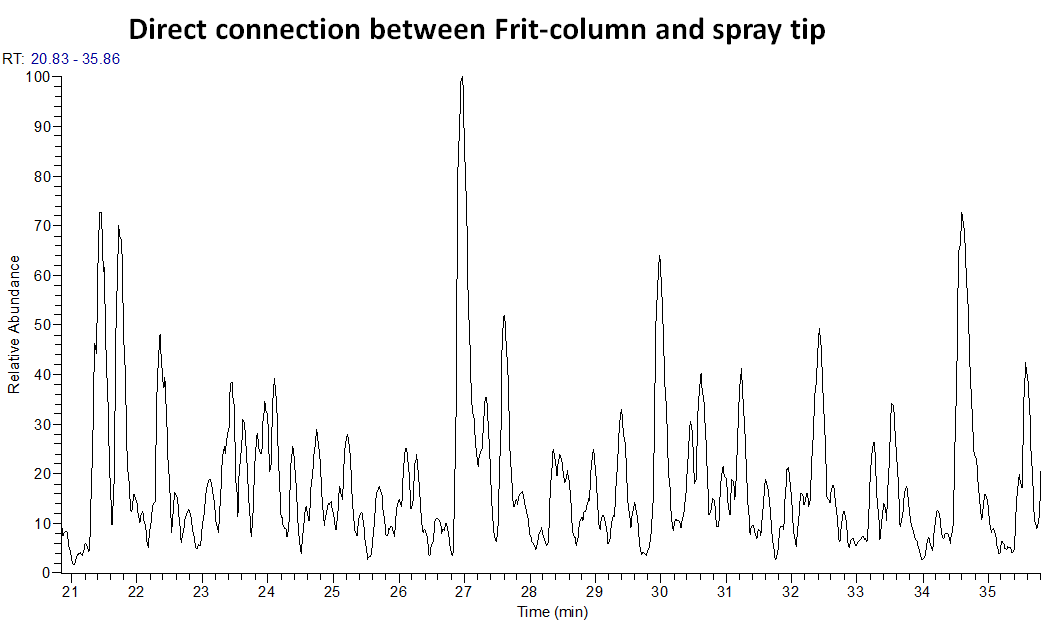
일단 업체에서 추천했던 방식을 해보았습니다. 개인적으로 컬럼 outlet의 void volume이 커지는것을 좋아하지 않기 때문에 추가 연결없이 시도해보았습니다. 즉 Silica spray tip끝에만 coating이 되어 이 부분에 voltage를 적용할수 있습니다. 하지만 이 spray tip에서는 안정적인 spray를 얻지 못하였습니다. 기존에도 이 spray tip 사용한 경험이 있었는데좋은 결과를 얻지 못하였습니다. 또한 Grounding cable에 의해서 voltage가 잘 전달되지 않는것 같습니다. Grounding cable을 제거하면 spray가 어느정도 안정적이나 다시 연결만 하면 drop이 생겼습니다. 아마 Tip 끝에 적용된 voltage가 grounding cable에 의해서 split되는것 같습니다(개인적인 추측)

µPACᵀᴹ Configuration (Additional connection for the spray tip)
어쩔수 없이 추가적인 연결을 하였습니다. 이 부분이 아주 중요합니다. 추가적인 연결선으로 인해 void volume이 커지게 되며 또한 완변한 연결이 되지 않으면 피크에 모양이 좋지 않게 나옵니다. 최적화 하는데 이 부분이 가장 어려웠습니다. 또한 이부분으로 인해 실험실에서 만들어 사용하는 Spray tip 일체형의 컬럼에 비해서 피크모양이 더 좋아지지는 않습니다.
최근 나온 논문에서 Configuration이 잘 그려져 있습니다.

저는 column outlet 과 spray tip 사이를 Pre-cut형태로 판매되는 PEEK Tubing을 사용하였습니다. Silica tubing을 절단하여 사용시 절단면이 완벽하지 않을수가 있습니다.
아래 그림은 실제 Thermo사의 Nanospray Flex source에 연결된 모습입니다. Metal spray tip을 사용하여 tip에 volage가 적용되도록 하였습니다. 기존의 여러형태의 Fused silica spray를 사용해보았는데 Metal spray가 가장 안정적인것 같습니다.

카메라에서 보여지는 Metal Spray tip의 모습입니다.

아래 그림은 Grounding cable을 Dionex LC 뒷편에 부착한 그림입니다.

기존 laser pulled column에 비해서는 연결하는것이 번거로운것은 사실입니다. 사실 연구소 여건상 한 장비에 이 configuraiton을 영구적으로 설치할수가 없습니다. 그래서 필요할때마다 바꾸어 주는것이 불편합니다. 정상적으로 연결된후 BSA 크로마토그램입니다. Grounding을 하지 않았을때 보이던 넓은 피크들이 없어졌습니다.

처음에 연결하는데 어려움이 있었습니다. 컬럼 outlet의 연결이 제대로 되지 않으면 피크 모양이 좋지 않게 됩니다. 아래는 동일한 컬럼이지만 여러가지로 튜빙및 spray tip을 사용훈 얻어진 크로마토그램입니다. Spray가 안정적이지 못해서 peak가 split되는 경우, spray tip안에서 bubble이 생기는 경우등으로 인해 피크의 넓이가 넓어지는 경우가 있습니다.
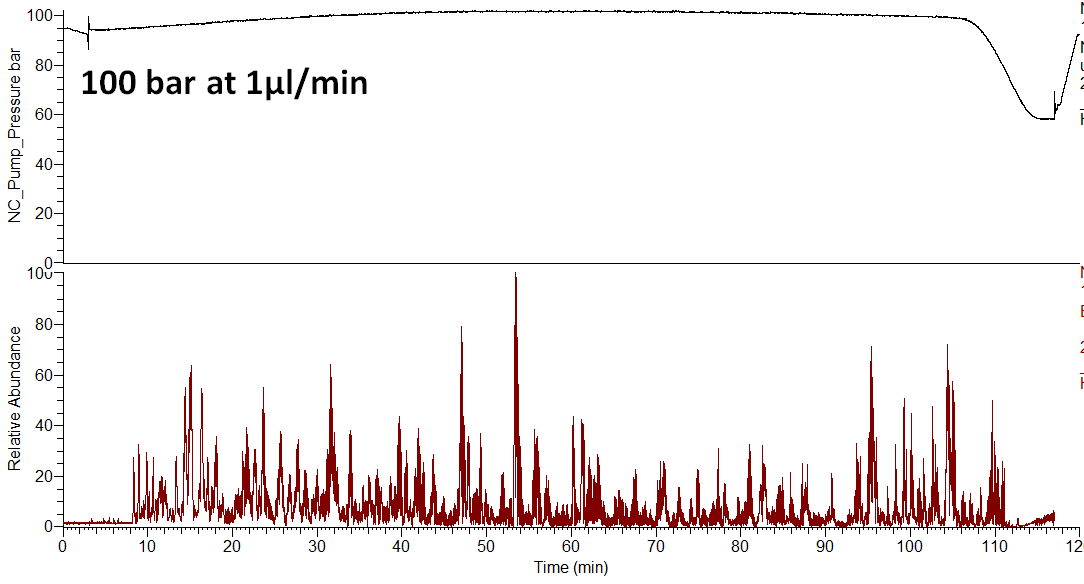
아래의 그림과 같이 1µL/min에서 압력이 100 bar 정도 밖에 걸리지 않습니다.
Ustable spray with a void volume and a bad connection
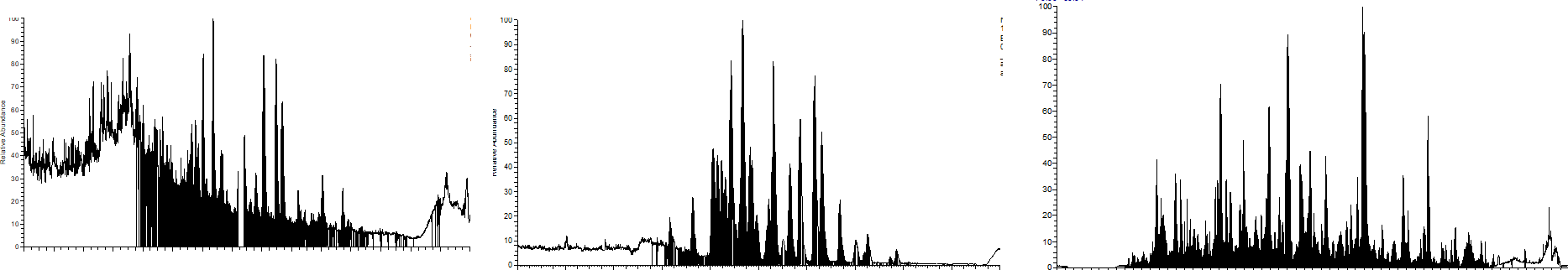
컬럼과 spray tip 사이에 여러 connection이 있거나 빈공간이 있을 경우 가장 일반적으로 많이 발생하는 문제점중 하나는 불안정한 Spraying 입니다. 이것은 컬럼의 문제가 아니라 컬럼과 Spray tip 사이의 연결이 완변하지 않을때 발생할수 있는 bubble, 빈공간으로 인해 발생할수 있는 bubble등으로 아래와 같이 spray가 안정적인지 못하고 침뱉기 처럼 불안정하게 됩니다. 또한 컬럼에서 용리되어 나온 펩타이드 피크가 빈공간에서 dilution이 되어 피크가 넓어지는 경우도 있습니다. 아래는 µPACᵀᴹ outlet이후 여러개의 connection으로 인해 발생할 수 있는 불안정한 Spray의 예입니다

이번에는 실험실에서 직접만든 Frit이 포함된 Fused silica capillary colum에 동일한 spray tip을 연결하였습니다. µPACᵀᴹ 에서의 연결과는 다르게 컬럼끝에 union으로 바로 spray tip을 연결하였습니다. 아래와 크로마토그램과 같이 위에서 발생한 문제점이 발생하지 않았습니다. 즉 이것은 Spray tip 자체의 문제라기 보다는 µPACᵀᴹ과 spray tip 사이의 연결에서 오는 문제점임을 알수 있습니다. 즉 이 부분에 주의를 하여 연결을 해야 됩니다.
µPACᵀᴹ LC Configuration
아래는 LC gradient setting 과 backpressure입니다. 1 µL/min 유속임에도 불구하고 100 bar정도 밖에 걸리지 않습니다.
micro pillar 형태의 컬럼의 장점입니다. 몇가지 논문을 보면 낮은 압력임에도 여전히 300 nL/min을 사용하는것을 보았습니다. 아마 높은 flow rate보다는 낮은 flow-rate에서 ESI 이온화가 효율적이기 때문이라 생각합니다.
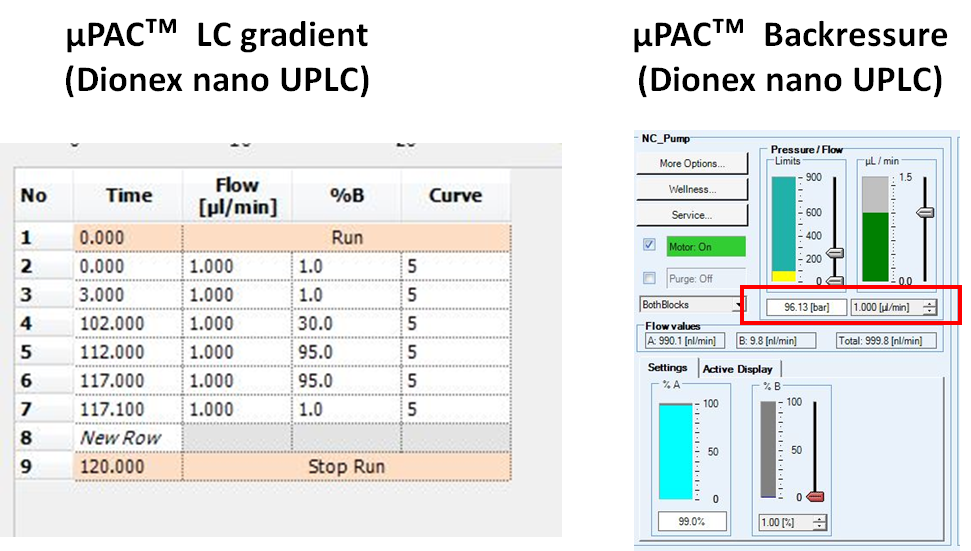
µPAC 컬럼의 경우 300 bar 이상에서 손상이 갈수 있다고 적혀있어서 LC에서 최대 압력은 300bar 이하로 셋팅을 해야 합니다. Dionext LC의 경우 최대압력을 설정할수 있지만 Easy nLC에서는 이 설정을 할수가 없습니다. 그러므로 갑자기 시스템의 압력이 300bar이상으로 올라갈 경우 Easy nLC에서 제어할수가 없습니다.
아래는 가장 최적화된 상태에서 Laser-pulled column과 µPAC 에서 분석한 HeLa digest (2hr gradient) 입니다. 전반적으로 많이 향상이 되었습니다.

µPACᵀᴹ Peak tailing
피크를 조금더 자세히 보게 되면 µPAC 컬럼에서의 피크는 여전히 tailing이 보입니다. 이 부분은 어쩔수 없는것 같습니다. Column outlet에서 spray tip까지 상대적으로 큰 void volume이 있기 때문일것 같습니다. 또한 각 tubing과 union을 완벽하게 연결하는것도 어렵습니다. 실험실에서 Fused silica tubing을 절단해서 사용할 경우 더욱 그렇습니다.

약간의 peak taining은 크게 문제가 되지 않을것입니다. 하지만 크로마토그래피를 전공한 나의 입장에서는 이 부분이 만족스럽지 못해서 여러 시도를 해보았지만 결국 해결은 하지 못했습니다. 높은 flow-rate으로 해결 할 수 있을것이라 생각했지만 향상은 되지 않았습니다.
Mathian Mann 그룹에서 최근에 발표한 논문 (Müller JB et.al. The proteome landscape of the kingdoms of life. Nature. 2020 Jun;582(7813):592-596)에 해당하는 raw 파일(PXD014877) 을 하나 다운받아서 피크모양을 확인해보았습니다. Trap column 없이 direct injection으로 분석한 크로마토그램입니다. 전반적으로 아주 좋습니다. 그래도 약간의 tailing이 있는것 같습니다. (시료를 많이 주입했을수도 있습니다)

아래는 최근에 Laser puller in-house column으로 분석한 BSA입니다. 아주 좋은 분해능을 가지고 있습니다. 단가로 치면 1불도 되지 않는 컬럼에서 아주 좋은 피크가 나옵니다. 분석하는 입장에서는 이런 좋은 분해능을 가지는 컬럼을 사용하고 싶을 것입니다.

하지만 기존의 컬럼에 비해서 µPACᵀᴹ 컬럼은 재현성, 컬럼의 사용횟수, backpressure등에서 많은 장점을 가지고 있는것 같습니다. 특히 많은 시료를 재현성 있게 분석해야 될 경우 한개의 컬럼으로 큰 프로젝트를 마칠수 있습니다.
Broken the inlet tubing of µPACᵀᴹ
안타깝게 컬럼에 부착된 tubing이 부러졌습니다. 아마 보관하는 과정에서 부러진것 같습니다. 단순히 휘어졌거나 손상이 미비하면 빠른 유속에서는 크게 문제가 없을것 같았습니다. 하지만 안타깝게도 고압력이 걸려서 더 이상 사용할수가 없었습니다. 연결된 tubing이 손상되었기 때문에 고가의 컬럼 전체를 사용하지 못하게 되는 불편함이 있네요
보관시 해당 박스에 잘 보관하는게 중요한것 같습니다.

Conclusion
셋팅을 하는데 어느정도 시간이 걸렸습니다. 그리고 컬럼의 분해능에 대해서도 어느정도 알수가 있었습니다. 단순한 단백질 분석에서는 기존의 Laser-pulled in-house 컬럼에 비해서는 큰 장점이 없을수도 있습니다. 하지만 장기간의 사용과 많은 수의 시료 분석이 필요한 큰 프로젝트에는 큰 도움이 될 것 같습니다.
관련글
Low Load µPAC Neo Column, 3,300 proteins with 1ngHeLa DIA (tistory.com)
Thermo사의 uPAC Gen2 컬럼 과 IonOpticks사의 Aurora컬럼 구매 (tistory.com)
Webinar: Thermo Scientific™ uPAC™ Neo HPLC Columns On-Demand (tistory.com)
Thermo µPAC Neo Column (50cm) (tistory.com)
Pharmafluidics 사의 µPACᵀᴹ 컬럼 사용후기 (tistory.com)
150 µm ID (내경) 컬럼의 nano column으로 낮은 압력으로 펩타이드 분리하기
150 µm ID (내경) 컬럼의 nano column으로 낮은 압력으로 펩타이드 분리하기
Nano LC를 이용한 펩타이드 분석에서 분리능을 향상시키기 위해서 최대한 사이즈를 줄이고 있습니다. LC 의 성능이 좋아져서 고압력에서도 운영이 가능하기 때문에 C18 material의 사이즈도 5 µm에서
proteomicstechnology.tistory.com
Thermo Easy-Spray Source 와 column (50 cm, 25cm)을 이용한 펩타이드 분리
Thermo Easy-Spray Source 와 column (50 cm, 25cm)을 이용한 펩타이드 분리
오래전에 Thermo 사의 Easy-Spray Source 와 Easy-Spray column을 구매하였으나 별로 사용하지 않았습니다. 실험실에서 충진해서 쓰는 컬럼으로도 분석서비스를 하는데는 큰 문제가 없습니다. 컬럼 한개가 $
proteomicstechnology.tistory.com
FlashPack: 빠르고 간단하게 분리능이 좋은 nano column 만들기
'프로테오믹스(단백체학)' 카테고리의 다른 글
| Nano LC 시스템에서 trap column의 셋팅과 역활 (2) | 2021.03.17 |
|---|---|
| Orbitrap Fusion에서 Intensity Threshold 설정에 따른 펩타이드 검출차이 (1) | 2021.03.10 |
| Comparison of BSA HCD, ETD, and EThCD Spectrum (0) | 2021.03.07 |
| EXP®2 TI-LOK™ Hand-Tight Adapters, UPLC에 Capillary 컬럼을 손쉽게 연결하기 (0) | 2021.03.05 |
| SDS buffer가 들어간 펩타이드 분석 (실패경험) (0) | 2021.03.04 |




댓글